A intenção deste post é ajudar pessoas que se encontram em situação similar a minha.
Fui notificado, meses atrás, pela farmácia de alto custo da cidade, que o Etanercepte (Pfizer) seria substituído por um outro “biossimilar” (Brenzys/Samsung).
O doutor reumatologista com quem trato minha doença/artrite reumatóide, não autorizou o uso do mesmo, alegando não existir estudos e testes que comprovem a sua eficácia.
Através da Defensoria Pública da União, por ordem judicial, eu já havia adquirido o direito ao fornecimento do medicamento para tratamento de minha doença. A DPU já intimou as rés para manifestação no prazo de 5 dias e agora estou aguardando um retorno da mesma.
Oriento as pessoas para que entre em contato com a DPU de sua cidade ou a mais próxima e busquem auxílio jurídico para que continue o tratamento com o medicamento adequado (ver requisitos primeiro em www.dpu.def.br).
Espero ter ajudado!
Relato de caso expontâneo do Sr. Edson Shiguenobu Yoshida na publicação
https://artritereumatoide.blog.br/etanercepte-biossimilar-fornecido-no-sus-somente-com-autorizacao-medica-em-prescricao-informa-secretaria-de-saude-do-estado-de-sao-paulo/
Recordando a situação de troca automática determinada pelo Ministério da Saúde
De acordo com a regra estabelecida pelo MS aos Estados, para dispensação do etanercepte 50mg/mL injetável (biossimilar), solicitamos que as LME realizem a divulgação e a orientação aos pacientes em tratamento mediante a entrega do folheto informativo (Anexo – 5).
Considerando que, o prescritor é quem deverá avaliar a melhor conduta terapêutica, caso a caso, a dispensação do etanercepte 50mg/mL injetável (biossimilar) deverá acontecer somente após a ciência do prescritor por meio de apresentação de relatório médico com registro da conduta que será adotada. Solicitamos priorizar o atendimento dos pacientes, após a avaliação médica, de acordo com as possíveis situações:
1. O prescritor autorizará a utilização do etanercepte 50mg/mL injetável (biossimilar): o relatório médico deverá ser arquivado junto à documentação do paciente;
2. O prescritor adequará a prescrição do paciente para outra alternativa terapêutica: neste caso, além do relatório médico e documentos pessoais, será necessário providenciar novo LME e exames conforme recomendações do Protocolo Clínico e Diretrizes Terapêuticas (PCDT) do medicamento prescrito;
3. Segundo a bula, o medicamento etanercepte 50mg/mL injetável biossimilar é contraindicado para tratamento em pacientes menores de 18 anos.
Assim:
a. O prescritor poderá solicitar o etanercepte 25mg/mL: será necessário providenciar novo LME e o relatório médico deverá ser arquivado junto à documentação do paciente;
b. O prescritor poderá optar por outra alternativa terapêutica: neste caso, além do relatório médico e documentos pessoais, será necessário providenciar novo LME e exames conforme recomendações do Protocolo Clínico e Diretrizes Terapêuticas (PCDT) do medicamento prescrito.
O medicamento etanercepte 50mg/mL injetável biossimilar ainda que indicado e utilizado corretamente, pode ocasionar eventos adversos imprevisíveis ou desconhecidos, por isso, é imprescindível que os farmacêuticos dos locais de dispensação de medicamentos do CEAF estimulem o paciente a informar a ocorrência de quaisquer eventos adversos e queixas após o início da terapia.
Caso o paciente relate eventos adversos após o uso dos medicamentos, os farmacêuticos dos locais de dispensação de medicamentos do CEAF deverão registrar a notificação no site da Agência Nacional de Vigilância Sanitária (ANVISA) ou do Centro de Vigilância Sanitária (CVS) da SES/SP, seguindo os seguintes passos:
1. Acessar o Portal do CVS – SES/SP: http://www.cvs.saude.sp.gov.br/
2. Clicar no link: “Notifique” > “Eventos Adversos e Queixas Técnicas de Produtos”
3. Clicar no link: “Notificação On line”.
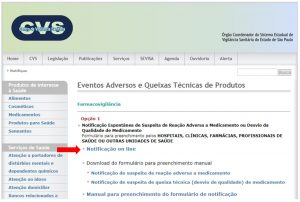
4. Preencher notificação com os dados e relatos do paciente, buscando inserir o maior número de informações solicitadas e detalhar o máximo possível o evento adverso.
Esta Nota Técnica entra em vigor na data de sua publicação, estando disponível no Portal da SES/SP.
Para acessá-la: – Acessar o Portal da SES/SP: www.saude.sp.gov.br ; – Clicar no link: “Medicamentos”; – Clicar no link: “Notas Técnicas da Assistência Farmacêutica”.
- Após decisão do Ministério da Saúde (NOTA TÉCNICA Nº 484/2019-CGCEAF/DAF/SCTIE/MS) em substituir automaticamente o medicamento biológico etanercepte (Enbrel®) pelo biossimilar (Brenzys®), a Secretaria de Saúde de São Paulo emitiu a Nota Técnica CAF nº 04, de 05 de setembro de 2019.
Fonte: SP – Centro de Vigilância Sanitária
Descubra mais sobre Artrite Reumatóide
Assine para receber nossas notícias mais recentes por e-mail.






























Boa tarde! A intenção deste post é ajudar pessoas que se encontram em situação similar a minha.
Fui notificado, meses atrás, pela farmácia de alto custo da cidade, que o Etanercepte (Pfizer) seria substituído por um outro “biossimilar” (Brenzys/Samsung). O doutor reumatologista com quem trato minha doença/artrite reumatóide, não autorizou o uso do mesmo, alegando não existir estudos e testes que comprovem a sua eficácia.
Através da Defensoria Pública da União, por ordem judicial, eu já havia adquirido o direito ao fornecimento do medicamento para tratamento de minha doença. A DPU já intimou as rés para manifestação no prazo de 5 dias e agora estou aguardando um retorno da mesma.
Oriento as pessoas para que entre em contato com a DPU de sua cidade ou a mais próxima e busquem auxílio jurídico para que continue o tratamento com o medicamento adequado (ver requisitos primeiro em http://www.dpu.def.br).
Espero ter ajudado!